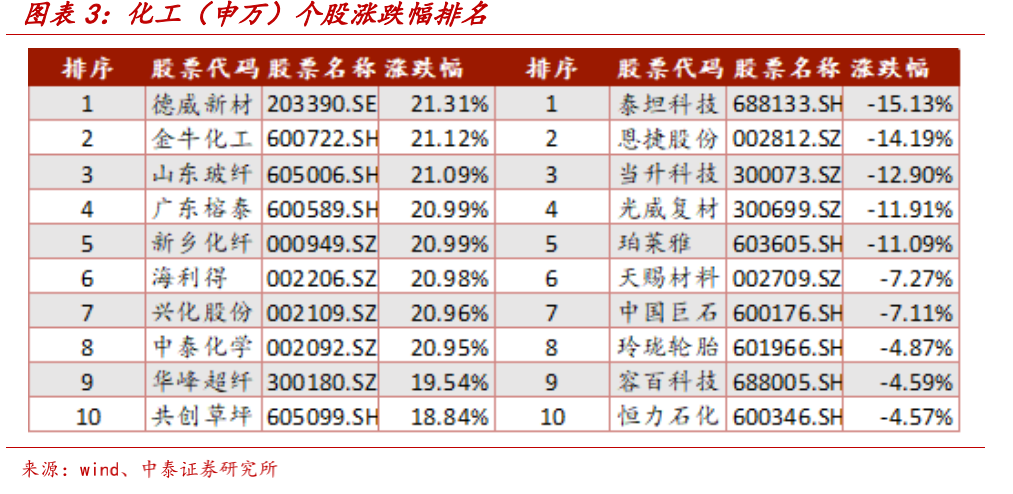
百奥泰3.4亿元“打水漂” 屡败屡战研发型企业业绩难看
- 来源:经济日报-中国经济网
- 时间:2021-03-22 17:08:59
继2月宣告主要疗效指标无进展生存期、相比对照组未达到预设优效目标,终止BAT8001临床试验后,3月,百奥泰再次宣告终止BAT8003及BAT1306两个临床试验项目。这意味着投资3.4亿元的项目宣告失败。
投资巨大却只能独下失败苦果,业绩巨亏扭亏漫漫无期——很多研发型药企投资新药研发后,只能留下一个悲怆背影。
百奥泰3.4亿元“打水漂”
BAT8003是百奥泰自主开发的一种创新药物,是一种靶向Trop2的ADC药物,临床适应症是Trop2阳性晚期上皮癌。BAT1306是百奥泰开发的针对免疫抑制检查点PD-1的单克隆抗体,单药适应症为EBV相关性胃癌,目前已开展BAT1306联合XELOX一线治疗EBV相关胃癌临床试验及BAT8001联合BAT1306二线治疗HER2阳性晚期实体瘤的临床试验。
为何将多年研究项目终止?百奥泰表示,BAT8003及BAT1306目前分别处于临床I期、II期,都属于较为早期阶段,后续开展临床试验还需要耗费公司大量人力财力。为聚焦研发管线中的优势项目,公司终止上述项目的临床试验。据悉,截至2020年12月,终止的三个项目,百奥泰共投资研发费用3.4亿元。
同日,百奥泰披露年报称,截至2020年12月31日,公司营业收入为18498.99万元,公司归属于母公司普通股股东的净利润为-51322.65万元,研发费用为56265.46万元,未来一段时间内,公司预期存在累计未弥补亏损并将持续亏损。记者了解到,2020年已是百奥泰连续亏损的第5个年头。

仅不到十分之一研发药品能获上市
事实上,在创新药如火如荼发展的今天,多年临床试验无果、项目终止的故事并不罕见。2020年12月30日,力生制药宣告,项目原预期结果难以达成,终止全资子公司生化制药23价肺炎球菌多糖疫苗。据悉,力生制药23价肺炎球菌多糖疫苗项目于2010年8月立项,于2020年12月30日宣告终止,公司累计投入约27875万元。随之带来的影响便是力生制药六年来(2015年)业绩首次下滑。其业绩快报显示,2020年公司净利润跌至946.81万元,同比下滑94.97%。
十年研究功亏一篑,不禁使人惋惜。但理性来看,新药研发具有高科技、高风险、高附加值的特点,药品从研制、临床试验报批到投产的周期长、环节多,容易受一些不确定性因素的影响,成功上市本就不易。《构建中国医药创新生态系统系列报告第一篇:2015-2020年发展回顾及未来展望》指出,只有不到8%的研发成果从临床I期可以转化成药品上市。
屡败屡战研发型企业业绩难看
高投资、高风险,但药企研发热情不减。经济日报-中国经济网记者了解到,近年来,包括百济神州、君实生物、信达生物、康希诺、神州细胞、康宁杰瑞制药、泽璟制药等研发型企业都在用近乎“孤注一掷”的勇气投入创新,业绩却连年亏损。
譬如,被堪称“最烧钱”的百济神州,高额研发的投入致公司亏空。其中,2020年,公司亏损近104亿元,而研发费用达84亿元。据经济日报-中国经济网记者不完全统计,自2016年来,百济神州研发投入近220亿元,累计亏损231亿元。
再如,“背水一战”的君实生物。君实生物目前在国内仅有一款药品上市,即PD-1抑制剂产品——特瑞普利单抗。2018年12月,特瑞普利单抗(拓益)正式获得国家药品监督管理局批准,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗,成为首个在中国成功上市的国产抗PD-1单抗药物,而这也是君实生物业绩的主要增长点。
然而,特瑞普利单抗的上市尚未解亏空之急。同百济神州一样,君实生物也已连续5年入不敷出。其2020年业绩快报显示,相比2019年,公司2020年营收、亏损双双翻倍,净利更是亏损达16.72亿元。据统计,至2019年,君实生物累计研发投入18.81亿元,累计亏损19.12亿元。

数字化有望减少创新风险
2020年是我国“重大新药创制”科技重大专项的收官之年。资料显示,“十三五”期间(2016年-2020年5月),国家药监部门共批准28个1类新药上市,包括16个化学药、8个治疗用生物制品和4个预防用生物制品,涵盖贝那鲁肽注射液、盐酸安罗替尼胶囊、罗沙司他胶囊、特瑞普利单抗注射液等多个重磅药物。
一面是“中国创”新药的可及性,一面是药企10年付出为之一搏的创新精神。从研究开发阶段药物靶点的发现、到临床试验、再到新药上市,一款新药的上市动辄10年时间、花费10亿美元。于药企而言,该如何面对创新药的研发风险?
业内人士指出,创新性药物临床研究的风险既有来自药物本身能否转化为产品的风险,也有临床试验过程中承担的伦理方面和受试者安全性方面的风险,还有来自于药品监管部门严格的审评审批制度的风险。在创新性药物临床试验过程中,如何通过建立机制,有效地规避或者减小临床试验中的风险以及风险所带来的损失,是所有创新药研发者面临的共同挑战。
值此,“十四五”开局,研发型企业如何规避风险、破茧成蝶值得思考。
《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》指出,要完善创新药物、疫苗、医疗器械等快速审评审批机制,加快临床急需和罕见病治疗药品、医疗器械审评审批,促进临床急需境外已上市新药和医疗器械尽快在境内上市。
专家指出,人工智能和大数据将有助于提升医药创新研发效率,覆盖靶点发现、药物筛选、临床研究等多个环节。新兴技术的应用对于中国医药健康数据的完整性、连接性和质量提出了更高要求,也有待制度层面的进一步改革突破。
随着创新药大环境的完善,未来创新药研发风险会减少。“数字化大背景确实给创新药的研发提供了崭新的契机,我们往常熟知的‘需要花费5-10亿美元,10到15年时间,才能成功研发一款新药’的说法在数字化的大背景下有望被打破。”中国药促会副会长、贝达药业董事长兼首席执行官丁列明日前表示。(朱国旺郭文培)